Es folgt eine Beschreibung der HCM aus dem Artikel von Dr. Ali Marian und Dr. Eugene Braunwald „Hypertrophe Kardiomyopathie: Genetik, Pathogenese, klinische Manifestationen, Diagnose und Therapie“:
Die hypertrophe Kardiomyopathie (HCM) ist eine genetisch bedingte Erkrankung, die durch eine nicht durch sekundäre Ursachen erklärbare linksventrikuläre Hypertrophie und einen nicht dilatierten linken Ventrikel mit erhaltener oder erhöhter Auswurffraktion gekennzeichnet ist. Sie ist in der Regel asymmetrisch, wobei die schwerste Hypertrophie das basale Interventrikelseptum betrifft. Eine Obstruktion des linksventrikulären Ausflusstrakts ist bei etwa einem Drittel der Patient*innen in Ruhe vorhanden und kann bei einem weiteren Drittel provoziert werden. Zu den histologischen Merkmalen der HCM gehören eine Myozytenhypertrophie und -disarray sowie eine interstitielle Fibrose. Die Hypertrophie ist häufig auch mit einer linksventrikulären diastolischen Dysfunktion verbunden.
In eine verständlichere Sprache übersetzt bedeutet das:
Genetik der HCM
Welche Genmutationen können HCM verursachen:
Normale Gene: Unser Körper hat Anweisungen (Gene), die unseren Zellen sagen, wie sie Proteine herstellen sollen, die wie Bausteine für unseren Körper sind.
Mutationen: Manchmal kann es zu Fehlern oder Veränderungen (Mutationen) in diesen Anweisungen kommen. Im Fall von HCM gibt es spezifische Genmutationen, die mit Proteinen im Herzmuskel zusammenhängen.
Proteinproduktion: Diese Mutationen führen dazu, dass die Zellen des Herzmuskels abnorme Proteine produzieren. Anstatt so zu arbeiten, wie sie sollten, können diese Proteine die Herzmuskelzellen zu stark wachsen lassen.
Dickere Herzwände: Infolgedessen werden die Herzwände dicker, ein Zustand, der als Hypertrophie bezeichnet wird. Dadurch kann es für das Herz schwieriger werden, das Blut effektiv zu pumpen, was zu Problemen wie Kurzatmigkeit oder Schmerzen in der Brust führt.
Vereinfacht gesagt, führen Genmutationen bei HCM zur Produktion abnormaler Proteine, die den Herzmuskel verdicken und es dem Herzen erschweren, seine Aufgabe richtig zu erfüllen.
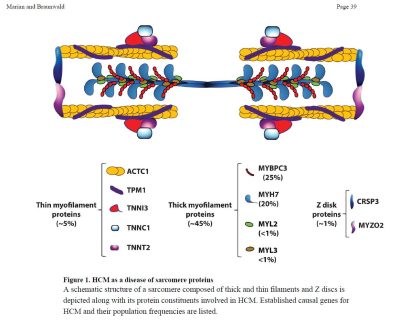 Beteiligte Gene: Von den bekannten ursächlichen Genen sind MYH7 und das myosinbindende Protein C (MYBPC3) die beiden häufigsten, die zusammen für etwa die Hälfte der Patient*innen mit familiärer HCM verantwortlich sind. Die Mutationen TNNT2, TNNI3 und TPM1 sind relativ seltene Ursachen für HCM und sind zusammen für weniger als 10 % der Fälle verantwortlich. Mutationen in ACTC1 (kardiales α-Actin), MYL2 (leichte Myosinkette 2), MYL3 (leichte Myosinkette 3) und CSRP3 (Cystein- und Glycin-reiches Protein 3) sind ebenfalls bekannte, wenn auch seltene Ursachen für HCM. Die kausale Rolle der oben genannten neun Gene bei HCM ist am stärksten bewiesen.
Beteiligte Gene: Von den bekannten ursächlichen Genen sind MYH7 und das myosinbindende Protein C (MYBPC3) die beiden häufigsten, die zusammen für etwa die Hälfte der Patient*innen mit familiärer HCM verantwortlich sind. Die Mutationen TNNT2, TNNI3 und TPM1 sind relativ seltene Ursachen für HCM und sind zusammen für weniger als 10 % der Fälle verantwortlich. Mutationen in ACTC1 (kardiales α-Actin), MYL2 (leichte Myosinkette 2), MYL3 (leichte Myosinkette 3) und CSRP3 (Cystein- und Glycin-reiches Protein 3) sind ebenfalls bekannte, wenn auch seltene Ursachen für HCM. Die kausale Rolle der oben genannten neun Gene bei HCM ist am stärksten bewiesen.
Mutationen in TTN (Titin), TCAP (Telethonin), MYOZ2 (Myozenin 2), TRIM63 (Ubiquitin-E3-Ligase Tripartit-Motiv-Protein 63 oder MuRF1) und FHL1 (viereinhalb LIM-Domänen 1) wurden ebenfalls als Ursache von HCM in Betracht gezogen, treten aber typischerweise nur in sporadischen Fällen und kleinen Familien auf.
Etwa 60 % der Patient*innen mit HCM haben eine klar erkennbare familiäre Erkrankung.
Ist die HCM eine für bestimmte Gruppen spezifische Krankheit? Nein. Die HCM ist eine Erkrankung ohne ausgeprägtes geografisches, ethnisches oder geschlechtsspezifisches Verteilungsmuster. Die Prävalenz der HCM wird auf 0,16 % bis 0,29 % (~ 1:625 bis 1:344 Personen) in der allgemeinen erwachsenen Bevölkerung geschätzt.
Wie wird das HCM-Gen weitergegeben? Wenn ein Elternteil eine Genmutation hat, die HCM verursacht, kann er das mutierte Gen an seine Kinder weitergeben. Jedes Kind hat eine 50:50-Chance, das mutierte Gen zu erben. Es ist wie beim Werfen einer Münze – sie kann auf Kopf (mit der Mutation) oder auf Zahl (ohne die Mutation) landen.
Es ist wichtig zu wissen, dass nicht alle Menschen mit HCM die Krankheit von ihren Eltern geerbt haben. Manchmal tritt die Genmutation bei einer Person zum ersten Mal auf, und sie ist die erste Person in ihrer Familie, die die Krankheit hat.
Glossar der Begriffe
Die alkoholische Septumablation ist eine Herzkathetertechnik, mit der die Behinderung des Blutausstoßes aus dem Herzen verringert werden soll. Die Technik erzeugt einen kleinen kontrollierten Herzinfarkt, der den für die Obstruktion verantwortlichen Bereich des Herzmuskels abtötet und schließlich dazu führt, dass er fibrosiert und dünner wird. Die Technik ähnelt der Koronarangioplastie und verwendet ähnliche Geräte. Mit Hilfe von Drähten und Ballons wird die Septumarterie, die den erkrankten Muskel versorgt, unter fluoroskopischer (Röntgen) und echokardiographischer (Ultraschall) Führung lokalisiert, dann wird eine geringe Menge reinen Alkohols in die Arterie infundiert, um einen kleinen Herzinfarkt zu erzeugen.
Die Angiografie oder Arteriografie ist ein bildgebendes Verfahren in der Medizin, mit dem das Innere oder Lumen von Blutgefäßen und Organen des Körpers sichtbar gemacht werden kann, wobei die Arterien, Venen und Herzkammern von besonderem Interesse sind. Dazu wird traditionell ein röntgendichtes Kontrastmittel in das Blutgefäß gespritzt und mit röntgenbasierten Techniken wie der Fluoroskopie dargestellt.
Vorhofflimmern (AF oder A-fib) ist ein abnormaler Herzrhythmus (Arrhythmie), der durch schnelles und unregelmäßiges Schlagen der Vorhofkammern des Herzens gekennzeichnet ist. Es beginnt oft mit kurzen Perioden abnormalen Schlagens, die mit der Zeit länger oder kontinuierlich werden. Es kann auch mit anderen Formen von Arrhythmien wie Vorhofflattern beginnen, die dann in Vorhofflimmern übergehen. Die Episoden können asymptomatisch sein. Vorhofflimmern kann in kurzen Episoden auftreten, es kann aber auch ein Dauerzustand sein.
Betablocker (Betablocker, β-Blocker usw.) sind eine Klasse von Medikamenten, die vor allem zur Behandlung von Herzrhythmusstörungen und zum Schutz des Herzens vor einem zweiten Herzinfarkt (Myokardinfarkt) nach einem ersten Herzinfarkt (Sekundärprävention) eingesetzt werden. Sie werden auch häufig zur Behandlung von Bluthochdruck (Hypertonie) eingesetzt, obwohl sie für die Erstbehandlung der meisten Patient*innen nicht mehr die erste Wahl sind. Einige weit verbreitete Betablocker-Marken sind Atenolol, Bisoprolol, Metoprolol und Nadolol.
Kalziumkanalblocker (CCB), Kalziumkanalantagonisten oder Kalziumantagonisten sind eine Gruppe von Medikamenten, die die Bewegung von Kalzium (Ca2+) durch Kalziumkanäle unterbrechen. Kalziumkanalblocker werden als Antihypertensiva eingesetzt, d. h. als Medikamente zur Senkung des Blutdrucks bei Patient*innen mit Bluthochdruck. CCBs sind besonders wirksam gegen die Versteifung der großen Gefäße, eine der häufigsten Ursachen für einen erhöhten systolischen Blutdruck bei älteren Patient*innen. Kalziumkanalblocker werden auch häufig zur Beeinflussung der Herzfrequenz (insbesondere bei Vorhofflimmern), zur Vorbeugung von peripheren und zerebralen Gefäßspasmen und zur Linderung von Brustschmerzen aufgrund von Angina pectoris eingesetzt.
Disopyramid (Handelsnamen Norpace und Rythmodan) ist ein Antiarrhythmikum, das zur Behandlung von Kammertachykardien eingesetzt wird. Es ist ein Natriumkanalblocker und wird daher als Antiarrhythmikum der Klasse 1 eingestuft.
Eine Echokardiographie, ein Echokardiogramm, ein Herzecho – oder einfach ein Echo – ist eine Ultraschalluntersuchung des Herzens. Es handelt sich um eine Art medizinischer Bildgebung des Herzens unter Verwendung von Standard-Ultraschall oder Doppler-Ultraschall.
Unter Elektrokardiographie versteht man die Erstellung eines Elektrokardiogramms (EKG oder EKG). Ein Elektrogramm des Herzens ist ein Diagramm der Spannung im Verhältnis zur Zeit der elektrischen Aktivität des Herzens, das mit Hilfe von auf der Haut angebrachten Elektroden erstellt wird. Diese Elektroden erfassen die kleinen elektrischen Veränderungen, die sich aus der Depolarisation des Herzmuskels und der anschließenden Repolarisation während jedes Herzzyklus (Herzschlag) ergeben. Veränderungen des normalen EKG-Musters treten bei zahlreichen Herzanomalien, einschließlich Herzrhythmusstörungen, auf.
Ein implantierbarer Kardioverter-Defibrillator (ICD) oder automatisierter implantierbarer Kardioverter-Defibrillator (AICD) ist ein Gerät, das in den Körper implantiert werden kann und in der Lage ist, eine Kardioversion, Defibrillation und (in modernen Versionen) eine Stimulation des Herzens durchzuführen. Das Gerät ist daher in der Lage, die meisten lebensbedrohlichen Herzrhythmusstörungen zu korrigieren.
Die Septum-Myektomie ist eine herzchirurgische Behandlung der hypertrophen Kardiomyopathie (HCM). Bei der Operation am offenen Herzen wird ein Teil der Scheidewand entfernt, der den Blutfluss von der linken Herzkammer zur Aorta behindert.
Obstruktion – je nachdem, ob die Verzerrung der normalen Herzanatomie zu einer Behinderung des Blutausflusses aus der linken Herzkammer führt oder nicht, kann die HCM als obstruktiv oder nichtobstruktiv eingestuft werden.
Ein Septum (lateinisch für etwas, das umschließt; Plural Septa) ist eine Wand, die einen Hohlraum oder eine Struktur in kleinere Räume unterteilt. Die Scheidewand des Herzens trennt die linke und rechte Seite.
Behandlungen für HCM
Wir leben in einer neuen, spannenden Ära, was die Entdeckung neuer HCM-Behandlungen betrifft. Bis vor kurzem konnte man die HCM-Symptome nur auf eine der folgenden Weisen behandeln:
1. Medikamente:
2. Chirurgische Eingriffe:
Diese chirurgischen Eingriffe müssen von erfahrenen Chirurgen in Zentren mit hohem Aufkommen durchgeführt werden
3. Implantierbare Geräte:
4. Änderungen der Lebensweise:
5. Regelmäßige Überwachung:
Die letzten Jahre brachten jedoch neue spannende Möglichkeiten für die Behandlung der Grunderkrankung selbst. Im Jahr 2023 genehmigte die Europäische Kommission Camzyos (mit dem Wirkstoff Mavacamten) für den Einsatz bei Patient*innen mit obstruktiver HCM in der Europäischen Union. Das Molekül ist ein Myosin-Inhibitor, der einen energiesparenden und superentspannten Zustand fördert, der sich in einer Verringerung der LVOT-Obstruktion und einer Verbesserung des Herzfüllungsdrucks niederschlägt. Camzyos ist ein Produkt von Bristol Myers Squibb und wird von diesem Pharmazieunternehmenvertrieben. Ein Molekül mit ähnlicher Wirkung, Aficamten, befindet sich derzeit (Stand Ende 2023) in der Spätphase von Studien sowohl für obstruktive als auch für nichtobstruktive Formen der HCM. Cytokinetics, das Unternehmen, das Aficamten entwickelt hat, erwartet die Zulassung im Jahr 2024. Kleinmolekulare Behandlungen haben bei Patient*innen hervorragende Ergebnisse gezeigt und stellen eine echte Alternative zu chirurgischen Lösungen für obstruktive HCM dar.
Ein weiterer spannender Trend ist das Aufkommen von Gentherapien. So startete Tenaya Therapeutics Anfang 2023 eine Phase-1-Studie mit TN-201, einer Gentherapie auf der Basis eines AAV (Adeno-assoziiertes Virus) zur Behandlung von Erwachsenen und Kindern mit HCM aufgrund von MYBPC3-Genmutationen, der häufigsten Form der genetischen HCM. Die Therapie soll bei der zugrunde liegenden Krankheitsursache ansetzen, indem ein voll funktionsfähiges MYBPC3-Gen zugeführt wird, um die normale Konzentration des MYBPC3-Proteins wiederherzustellen. Damit besteht die Hoffnung, dass das Fortschreiten der Krankheit gestoppt und der Verlauf der genetischen HCM nach einer einzigen Behandlung umgekehrt werden kann!