Ecco una descrizione della CMI tratta dall’articolo del Dr. Ali Marian e del Dr. Eugene Braunwald “Cardiomiopatia ipertrofica: Genetica, patogenesi, manifestazioni cliniche, diagnosi e terapia”:
La cardiomiopatia ipertrofica (CMI) è una malattia genetica caratterizzata da ipertrofia ventricolare sinistra non spiegata da cause secondarie e da un ventricolo sinistro non dilatato con frazione di eiezione conservata o aumentata. È comunemente asimmetrica e l’ipertrofia più grave coinvolge il setto interventricolare basale. L’ostruzione del tratto di efflusso del ventricolo sinistro è presente a riposo in circa un terzo dei pazienti e può essere provocata in un altro terzo. Le caratteristiche istologiche della CMI comprendono ipertrofia e disordine dei miociti e fibrosi interstiziale. L’ipertrofia è spesso associata a disfunzione diastolica del ventricolo sinistro.
Proviamo a tradurlo in un linguaggio più comprensibile, che ne dite?
Genetica della CMI
Vediamo come le mutazioni genetiche possono causare la CMI:
Istruzioni normali: Il nostro corpo ha delle istruzioni (geni) che indicano alle nostre cellule come produrre le proteine, che sono come i mattoni del nostro corpo.
Mutazioni: A volte possono esserci errori o cambiamenti (mutazioni) in queste istruzioni. Nel caso della CMI, vi sono mutazioni genetiche specifiche relative a proteine del muscolo cardiaco.
Produzione di proteine: Queste mutazioni fanno sì che le cellule del muscolo cardiaco producano proteine anomale. Invece di funzionare come dovrebbero, queste proteine possono far crescere eccessivamente le cellule del muscolo cardiaco.
Pareti cardiache più spesse: Di conseguenza, le pareti del cuore diventano più spesse, una condizione nota come ipertrofia. Questo può rendere più difficile per il cuore pompare il sangue in modo efficace, causando problemi come mancanza di respiro o dolore al petto.
In parole povere, le mutazioni genetiche nella CMI portano alla produzione di proteine anomale che causano l’ispessimento del muscolo cardiaco, rendendo più difficile per il cuore svolgere correttamente il proprio lavoro.
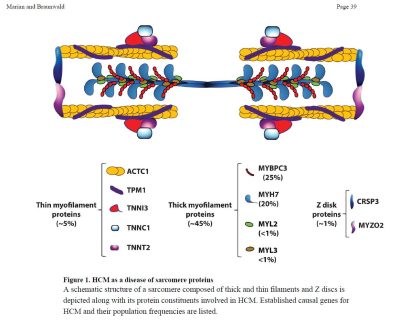
Geni coinvolti: Tra i geni causali noti, MYH7 e la proteina legante miosina C (MYBPC3) sono i due più comuni e insieme sono responsabili di circa la metà dei pazienti con CMI familiare. Le mutazioni TNNT2, TNNI3 e TPM1 sono cause relativamente poco comuni di CMI e insieme sono responsabili di meno del 10% dei casi. Anche le mutazioni in ACTC1 (α-actina cardiaca), MYL2 (catena leggera della miosina 2), MYL3 (catena leggera della miosina 3) e CSRP3 (proteina 3 ricca di cisteina e glicina) sono cause accertate, anche se non comuni, di CMI. L’evidenza del ruolo causale dei nove geni sopra citati nella CMI è la più forte.
Anche le mutazioni in TTN (titina), TCAP (teletonina), MYOZ2 (miozenina 2), TRIM63 (ubiquitina E3 ligasi tripartita o MuRF1) e FHL1 (quattro domini e mezzo LIM 1) sono state implicate come cause della CMI, ma si verificano tipicamente in casi sporadici e in piccole famiglie.
Circa il 60% dei pazienti con CMI presenta una malattia familiare chiaramente riconoscibile.
La CMI è una malattia specifica di alcuni gruppi? No. La CMI è una patologia che non presenta un modello di distribuzione geografico, etnico o di sesso distinto. La prevalenza della CMI è stata stimata tra lo 0,16% e lo 0,29% (~ 1:625-1:344 individui) nella popolazione adulta generale.
Come si trasmette il gene della CMI? Se un genitore ha una mutazione genetica che causa la CMI, può trasmettere il gene mutato ai propri figli alla nascita. Ogni figlio ha il 50% di possibilità di ereditare il gene mutato. È come lanciare una moneta: può uscire testa (con la mutazione) o croce (senza la mutazione).
È importante notare che non tutti i soggetti affetti da CMI l’hanno ereditata dai genitori. A volte la mutazione genetica può verificarsi per la prima volta in una persona, che diventa la prima della sua famiglia ad averla.
Glossario dei termini
L’ablazione del setto alcolico è una tecnica di cateterismo cardiaco che mira a ridurre l’ostruzione all’espulsione del sangue dal cuore. La tecnica crea un piccolo infarto miocardico controllato, uccidendo l’area del muscolo cardiaco responsabile dell’ostruzione e causando alla fine la fibrosi e la riduzione dello spessore. La tecnica è simile all’angioplastica coronarica e utilizza apparecchiature simili. Fili e palloncini vengono utilizzati per localizzare l’arteria settale che alimenta il muscolo malato sotto guida fluoroscopica (raggi X) ed ecocardiografica (ultrasuoni), quindi una piccola quantità di alcol puro viene infusa nell’arteria per produrre un piccolo infarto.
L’angiografia o arteriografia è una tecnica di imaging medico utilizzata per visualizzare l’interno, o il lume, dei vasi sanguigni e degli organi del corpo, con particolare interesse per le arterie, le vene e le camere cardiache. Tradizionalmente viene eseguita iniettando un agente di contrasto radiopaco nei vasi sanguigni e imitando le immagini con tecniche basate sui raggi X, come la fluoroscopia.
La fibrillazione atriale (FA o fibrillazione atriale) è un ritmo cardiaco anomalo (aritmia) caratterizzato da un battito rapido e irregolare delle camere atriali del cuore. Spesso inizia con brevi periodi di battito anomalo, che diventano più lunghi o continui nel tempo. Può anche iniziare come altre forme di aritmia, come il flutter atriale, che poi si trasforma in fibrillazione atriale. Gli episodi possono essere asintomatici. La fibrillazione atriale può manifestarsi in brevi episodi o essere una condizione permanente.
I betabloccanti (beta-bloccanti, β-bloccanti, ecc.) sono una classe di farmaci utilizzati prevalentemente per gestire i ritmi cardiaci anomali e per proteggere il cuore da un secondo attacco cardiaco (infarto miocardico) dopo un primo attacco cardiaco (prevenzione secondaria). Sono anche ampiamente utilizzati per trattare l’ipertensione, anche se non sono più la prima scelta per il trattamento iniziale della maggior parte dei pazienti. Alcune marche di betabloccanti ampiamente utilizzate sono Atenololo, Bisoprololo, Metoprololo e Nadololo.
I calcio-antagonisti (CCB), antagonisti dei canali del calcio o antagonisti del calcio, sono un gruppo di farmaci che interrompono il movimento del calcio (Ca2+) attraverso i canali del calcio. I calcio-antagonisti sono utilizzati come farmaci antipertensivi, cioè come farmaci per ridurre la pressione sanguigna nei pazienti con ipertensione. I CCB sono particolarmente efficaci contro la rigidità dei grandi vasi, una delle cause comuni dell’aumento della pressione arteriosa sistolica nei pazienti anziani. I calcio-antagonisti sono spesso utilizzati anche per modificare la frequenza cardiaca (soprattutto in caso di fibrillazione atriale), per prevenire il vasospasmo periferico e cerebrale e per ridurre il dolore toracico causato dall’angina pectoris.
La disopiramide (nomi commerciali Norpace e Rythmodan) è un farmaco antiaritmico utilizzato nel trattamento della tachicardia ventricolare. È un bloccante dei canali del sodio e pertanto è classificato come agente antiaritmico di Classe 1.
L’ecocardiografia, l’ecocardiogramma, l’eco cardiaco o semplicemente l’eco è un’ecografia del cuore. È un tipo di imaging medico del cuore che utilizza ultrasuoni standard o ultrasuoni Doppler.
L’elettrocardiografia è il processo di produzione di un elettrocardiogramma (ECG o ECG). L’elettrocardiogramma del cuore è un grafico del voltaggio rispetto al tempo dell’attività elettrica del cuore, ottenuto utilizzando elettrodi posizionati sulla pelle. Questi elettrodi rilevano le piccole variazioni elettriche che sono la conseguenza della depolarizzazione del muscolo cardiaco seguita dalla ripolarizzazione durante ogni ciclo cardiaco (battito cardiaco). Le alterazioni del normale tracciato ECG si verificano in numerose anomalie cardiache, tra cui i disturbi del ritmo cardiaco.
Un cardioverter-defibrillatore impiantabile (ICD) o cardioverter-defibrillatore impiantabile automatico (AICD) è un dispositivo impiantabile all’interno del corpo, in grado di eseguire la cardioversione, la defibrillazione e (nelle versioni moderne) la stimolazione del cuore. Il dispositivo è quindi in grado di correggere la maggior parte delle aritmie cardiache pericolose per la vita.
La miectomia settale è un trattamento cardiochirurgico per la cardiomiopatia ipertrofica (CMI). L’intervento a cuore aperto consiste nella rimozione di una porzione del setto che ostruisce il flusso di sangue dal ventricolo sinistro all’aorta.
Ostruzione – a seconda che l’alterazione della normale anatomia cardiaca provochi un’ostruzione del deflusso del sangue dal ventricolo sinistro del cuore, la CMI può essere classificata come ostruttiva o non ostruttiva.
Un setto (in latino, qualcosa che racchiude; plurale septa) è una parete che divide una cavità o una struttura in altre più piccole. Il setto del cuore divide il lato destro da quello sinistro.
Trattamenti per la CMI
Stiamo vivendo una nuova ed entusiasmante era nella scoperta di nuovi trattamenti per la CMI. Fino a poco tempo fa, tutto ciò che si poteva fare era gestire i sintomi della CMI in uno dei seguenti modi:
1. Farmaci:
2. Procedure chirurgiche:
Queste procedure chirurgiche devono essere eseguite da chirurghi esperti in centri ad alto volume.
3. Dispositivi impiantabili:
4. Modifiche dello stile di vita:
5. Monitoraggio regolare:
Gli ultimi anni, tuttavia, hanno portato nuove entusiasmanti possibilità di trattamento della patologia di base stessa. Nel 2023 la Commissione Europea ha approvato Camzyos (con il principio attivo mavacamten) per l’uso nell’Unione Europea con pazienti affetti da CMI ostruttiva. La molecola è un inibitore della miosina, che promuove uno stato di risparmio energetico e di super-rilassamento che si traduce in una riduzione dell’ostruzione dell’LVOT e in un miglioramento delle pressioni di riempimento cardiaco. Camzyos è di proprietà e distribuito da Bristol Myers Squibb. Una molecola con un’azione simile, aficamten, è attualmente (alla fine del 2023) in fase avanzata di sperimentazione per le forme ostruttive e non ostruttive di CMI. Cytokinetics, l’azienda che ha sviluppato aficamten, prevede l’approvazione nel 2024. I trattamenti con piccole molecole hanno mostrato risultati eccellenti nei pazienti, rappresentando una valida alternativa alle soluzioni chirurgiche per la CMI ostruttiva.
Un’altra tendenza interessante è l’emergere delle terapie geniche. Ad esempio, all’inizio del 2023 Tenaya Therapeutics ha avviato uno studio di Fase 1 su TN-201, una terapia genica basata sul virus adeno-associato (AAV) progettata per trattare adulti e bambini affetti da CMI dovuta a mutazioni del gene MYBPC3, la forma più diffusa di CMI genetica. La terapia mira ad affrontare la causa alla base della malattia fornendo un gene MYBPC3 completamente funzionale per ripristinare i normali livelli di proteina MYBPC3, con la speranza di arrestare potenzialmente la progressione della malattia e invertire il corso della CMI genetica dopo un singolo trattamento!