Hier volgt een beschrijving van HCM uit het artikel van Dr. Ali Marian en Dr. Eugene Braunwald “Hypertrophic Cardiomyopathy: Genetica, pathogenese, klinische manifestaties, diagnose en therapie”:
Hypertrofische cardiomyopathie (HCM) is een genetische aandoening die wordt gekenmerkt door linkerventrikelhypertrofie zonder secundaire oorzaken en een niet-verwijd linkerventrikel met behouden of verhoogde ejectiefractie. De aandoening is meestal asymmetrisch, waarbij de ernstigste hypertrofie het basale interventriculaire septum betreft. Bij ongeveer een derde van de patiënten is er sprake van obstructie van het linker ventrikel outflow tract in rust en bij nog eens een derde kan de obstructie worden uitgelokt. De histologische kenmerken van HCM zijn onder andere myocytenhypertrofie en disarray, evenals interstitiële fibrose. De hypertrofie gaat ook vaak gepaard met diastolische disfunctie van de linkerventrikel.
Zullen we dat proberen te vertalen in een begrijpelijkere taal?
Genetica van HCM
Laten we eens kijken hoe genmutaties HCM kunnen veroorzaken:
Normale instructies: Ons lichaam heeft instructies (genen) die onze cellen vertellen hoe ze eiwitten moeten maken, die als de bouwstenen voor ons lichaam zijn.
Mutaties: Soms kunnen er fouten of veranderingen (mutaties) in deze instructies zitten. In het geval van HCM zijn er specifieke genmutaties met betrekking tot eiwitten in de hartspier.
Eiwitproductie: Deze mutaties zorgen ervoor dat de cellen in de hartspier abnormale eiwitten produceren. In plaats van te werken zoals het hoort, kunnen deze eiwitten ervoor zorgen dat de hartspiercellen te veel groeien.
Dikkere hartwanden: Als gevolg hiervan worden de wanden van het hart dikker, een aandoening die hypertrofie wordt genoemd. Dit kan het moeilijker maken voor het hart om het bloed effectief te pompen, wat kan leiden tot problemen zoals kortademigheid of pijn op de borst.
Eenvoudig gezegd leiden genmutaties bij HCM tot de productie van abnormale eiwitten die ervoor zorgen dat de hartspier dikker wordt, waardoor het voor het hart moeilijker wordt om zijn werk goed te doen.
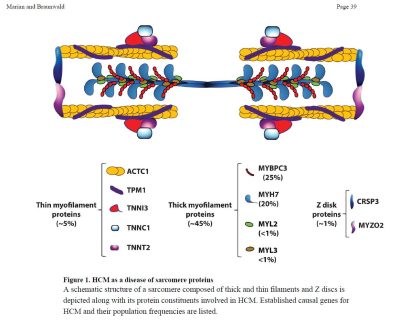
Betrokken genen: Van de bekende causale genen zijn MYH7 en myosine bindend eiwit C (MYBPC3) de twee meest voorkomende, samen verantwoordelijk voor ongeveer de helft van de patiënten met familiaire HCM. Mutaties TNNT2, TNNI3 en TPM1 zijn relatief zeldzame oorzaken van HCM en zijn samen verantwoordelijk voor minder dan 10% van de gevallen. Mutaties in ACTC1 (cardiaal α-actine), MYL2 (myosine lichte keten 2), MYL3 (myosine lichte keten 3) en CSRP3 (Cysteïne en Glycine Rijk Eiwit 3) zijn ook bewezen, zij het zeldzame, oorzaken van HCM. Het bewijs voor de oorzakelijke rol van bovenstaande negen genen bij HCM is het sterkst.
Mutaties in TTN (titine), TCAP (telethonine), MYOZ2 (myozenine 2), TRIM63 (ubiquitine E3 ligase tripartite motif protein 63 of MuRF1) en FHL1 (vier en een half LIM domeinen 1) zijn ook geïmpliceerd als oorzaken van HCM, maar komen typisch voor in sporadische gevallen en kleine families.
Ongeveer 60% van de patiënten met HCM heeft een duidelijk herkenbare familiaire aandoening.
Is HCM een ziekte die specifiek is voor bepaalde groepen? HCM is een aandoening zonder een duidelijk geografisch, etnisch of geslachtspatroon. De prevalentie van HCM is geschat op 0,16% – 0,29% (~ 1:625 tot 1:344 personen) in de algemene volwassen bevolking.
Hoe wordt het HCM-gen doorgegeven? Als een ouder een genmutatie heeft die HCM veroorzaakt, kunnen ze dat gemuteerde gen doorgeven aan hun kinderen. Elk kind heeft een 50-50 kans om het gemuteerde gen te erven. Het is alsof je een munt opgooit – de munt kan op kop (met de mutatie) of munt (zonder de mutatie) vallen.
Het is belangrijk om te weten dat niet iedereen met HCM het van zijn ouders heeft. Soms komt de genmutatie voor het eerst voor bij een persoon en wordt hij of zij de eerste in de familie die het heeft.
Verklarende woordenlijst
Alcoholseptalablatie is een hartkatheterisatietechniek die ontworpen is om de belemmering van de bloedafvoer uit het hart te verminderen. De techniek creëert een klein gecontroleerd myocardinfarct, waardoor het gedeelte van de hartspier dat verantwoordelijk is voor de obstructie wordt gedood en uiteindelijk fibroseert en minder dik wordt. De techniek is vergelijkbaar met coronaire angioplastiek en maakt gebruik van vergelijkbare apparatuur. Draden en ballonnen worden gebruikt om de septale slagader die de zieke spier voedt te lokaliseren onder zowel fluoroscopische (röntgen) als echocardiografische (ultrageluid) begeleiding, waarna een kleine hoeveelheid pure alcohol in de slagader wordt geïnfundeerd om een kleine hartaanval te veroorzaken.
Angiografie of arteriografie is een medische beeldvormingstechniek die wordt gebruikt om de binnenkant, of het lumen, van bloedvaten en organen van het lichaam te visualiseren, met speciale interesse in de slagaders, aders en de hartkamers. Dit wordt traditioneel gedaan door een radio-opaak contrastmiddel in het bloedvat te injecteren en beelden te maken met behulp van röntgentechnieken zoals fluoroscopie.
Atriumfibrillatie (AF of A-fib) is een abnormaal hartritme (aritmie) dat gekenmerkt wordt door snel en onregelmatig kloppen van de boezems van het hart. Het begint vaak met korte periodes van abnormaal kloppen, die na verloop van tijd langer of ononderbroken worden. Het kan ook beginnen als andere vormen van hartritmestoornissen zoals boezemfladderen die dan veranderen in AF. Episoden kunnen asymptomatisch zijn. AF kan optreden in korte episodes of het kan een permanente aandoening zijn.
Bètablokkers (bètablokkers, β-blokkers, enz.) zijn een klasse medicijnen die voornamelijk worden gebruikt om abnormale hartritmes te beheersen en om het hart te beschermen tegen een tweede hartaanval (myocardinfarct) na een eerste hartaanval (secundaire preventie). Ze worden ook veel gebruikt voor de behandeling van hoge bloeddruk (hypertensie), hoewel ze niet langer de eerste keuze zijn voor de eerste behandeling van de meeste patiënten. Enkele veelgebruikte merken bètablokkers zijn Atenolol, Bisoprolol, Metoprolol en Nadolol.
Calciumkanaalblokkers (CCB), calciumkanaalantagonisten of calciumantagonisten zijn een groep geneesmiddelen die de beweging van calcium (Ca2+) door calciumkanalen verstoren. Calciumkanaalblokkers worden gebruikt als antihypertensiva, d.w.z. als medicijnen om de bloeddruk te verlagen bij patiënten met hypertensie. CCB’s zijn vooral effectief tegen grote vaatstijfheid, een van de veel voorkomende oorzaken van verhoogde systolische bloeddruk bij oudere patiënten. Calciumkanaalblokkers worden ook vaak gebruikt om de hartslag te veranderen (vooral bij boezemfibrilleren), om perifere en cerebrale vasospasmen te voorkomen en om pijn op de borst veroorzaakt door angina pectoris te verminderen.
Disopyramide (handelsnamen Norpace en Rythmodan) is een antiaritmicum dat wordt gebruikt bij de behandeling van ventriculaire tachycardie. Het is een natriumkanaalblokker en daarom geclassificeerd als een klasse 1 antiaritmicum.
Een echocardiografie, echocardiogram, cardiale echo – of gewoon een echo – is een echografie van het hart. Het is een soort medische beeldvorming van het hart met behulp van standaard echografie of Doppler-echografie.
Elektrocardiografie is het proces van het maken van een elektrocardiogram (ECG of EKG). Een elektrogram van het hart is een grafiek van spanning versus tijd van de elektrische activiteit van het hart die wordt verkregen met behulp van elektroden die op de huid worden geplaatst. Deze elektroden detecteren de kleine elektrische veranderingen die het gevolg zijn van depolarisatie van de hartspier gevolgd door repolarisatie tijdens elke hartcyclus (hartslag). Veranderingen in het normale ECG-patroon treden op bij talrijke hartafwijkingen, waaronder hartritmestoornissen.
Een implanteerbare cardioverter-defibrillator (ICD) of automatische implanteerbare cardioverter-defibrillator (AICD) is een apparaat dat in het lichaam kan worden geïmplanteerd en dat cardioversie, defibrillatie en (in moderne versies) pacing van het hart kan uitvoeren. Het apparaat is daarom in staat om de meeste levensbedreigende hartritmestoornissen te corrigeren.
Septale myectomie is een hartchirurgische behandeling voor hypertrofische cardiomyopathie (HCM). Bij deze openhartoperatie wordt een deel van het septum verwijderd dat de bloedstroom van de linkerhartkamer naar de aorta belemmert.
Obstructie – afhankelijk van het feit of de verstoring van de normale anatomie van het hart een obstructie van de uitstroom van bloed uit de linkerhartkamer veroorzaakt, kan HCM worden geclassificeerd als obstructief of niet-obstructief.
Een septum (Latijn voor iets dat omsluit; meervoud septa) is een wand die een holte of structuur in kleinere verdeelt. Het tussenschot van het hart verdeelt de linker- en rechterkant
.
Behandelingen voor HCM
We leven in een nieuw, opwindend tijdperk wat betreft de ontdekking van nieuwe HCM-behandelingen. Tot voor kort was het enige wat men kon doen de symptomen van HCM op een van de volgende manieren beheersen:
1. Medicijnen:
2. Chirurgische procedures:
Deze chirurgische procedures moeten worden uitgevoerd door ervaren chirurgen in centra met hoge volumes.
3. Implanteerbare apparaten:
4. Aanpassingen in levensstijl:
5. Regelmatige controle:
De afgelopen jaren brachten echter nieuwe opwindende mogelijkheden voor de behandeling van de onderliggende aandoening zelf. In 2023 keurde de Europese Commissie Camzyos (met werkzame stof mavacamten) goed voor gebruik in de Europese Unie bij obstructieve HCM-patiënten. De molecule is een myosineremmer, die een energiebesparende en superrelaxte toestand bevordert die zich vertaalt in een vermindering van de LVOT-obstructie en een verbetering van de vuldruk van het hart. Camzyos is eigendom van en wordt gedistribueerd door Bristol Myers Squibb. Een molecuul met een vergelijkbare werking, aficamten, bevindt zich momenteel (vanaf eind 2023) in een vergevorderd onderzoeksstadium voor zowel obstructieve als niet-obstructieve vormen van HCM. Cytokinetics, het bedrijf dat aficamten heeft ontwikkeld, verwacht goedkeuring in 2024. Behandelingen met kleine moleculen hebben uitstekende resultaten laten zien bij patiënten en vormen een haalbaar alternatief voor chirurgische oplossingen voor obstructieve HCM.
Een andere opwindende trend is de opkomst van gentherapieën. Tenaya Therapeutics is bijvoorbeeld begin 2023 gestart met een Fase 1-studie van TN-201, een op adeno-geassocieerd virus (AAV)-gebaseerde gentherapie die is ontwikkeld voor de behandeling van volwassenen en kinderen met HCM als gevolg van MYBPC3-genmutaties, de meest voorkomende vorm van genetische HCM. De therapie is bedoeld om de onderliggende oorzaak van de ziekte aan te pakken door het toedienen van een volledig functioneel MYBPC3-gen om de normale niveaus van MYBPC3-eiwit te herstellen, in de hoop mogelijk de ziekteprogressie te stoppen en het verloop van genetische HCM om te keren na één enkele behandeling!